
2023年12月8日,美国食品药品监督管理局(FDA)一次性批准了两种针对镰状细胞病的基因治疗方法,它们分别是福泰制药与CRISPR Therapeutics共同研发的基因编辑疗法Casgevy、蓝鸟生物的基因编辑疗法Lyfgenia。其中Casgevy作为首个基于CRISPR基因编辑技术的疗法,又于2024年1月16日,被FDA批准用于治疗12岁及以上患者的输血依赖性β地中海贫血。
01 Casgevy和Lyfgenia治疗镰状细胞病的原理
全球两千万镰状细胞病患者中,绝大多数分布在非洲落后地区,而美国患者约为10万人。镰状细胞病备受关注,不仅因为它是全球最知名的遗传病,而且其遗传机制已成为遗传学经典教科书内容。
该病因血红蛋白β链上的一个氨基酸变异导致,使血红蛋白在缺氧条件下纤维化,使红细胞变形成极易破碎的“镰刀”形态,引发血管阻塞危象,导致器官受损。尽管已有多种药物能减轻症状,但无法治愈该病。
镰状细胞病因其单基因遗传特性、对血红蛋白水平宽容度以及病变范围局限于红细胞等因素,适合基因治疗。在基因治疗尚未上市前,异体干细胞移植曾是一种治愈疗法,但患者很难找到合适的捐赠者。基因疗法似乎是命运般的解决方案。
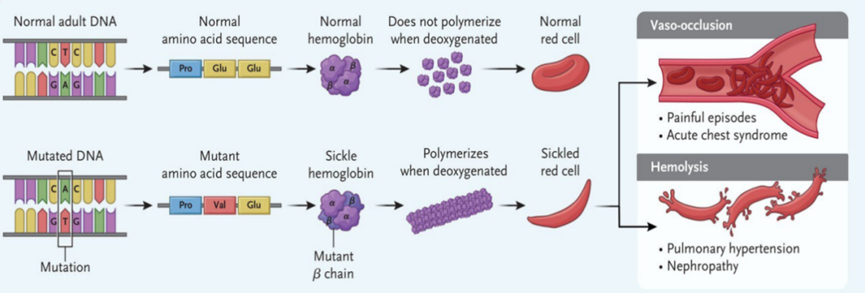
镰状细胞病的致病机理【2】
镰状细胞病的基因治疗旨在使患者的造血干细胞产生正常的血红蛋白。Lyfgenia利用慢病毒载体将携带T87Q变异的血红蛋白β链引入患者的造血干细胞,从而产生功能正常的血红蛋白。类似地,已上市的多个CAR-T治疗也是利用慢病毒载体引入CAR基因至患者的一类血细胞,T细胞中。
Casgevy引发了更多关注,因为它是首个采用CRISPR基因编辑技术的基因治疗。CRISPR基因编辑技术自2020年获得诺贝尔奖以来,彻底改变了基因编辑领域,并成为广泛使用的生物技术之一。不同于Lyfgenia使用病毒载体引入外源基因,Casgevy则利用CRISPR/Cas9系统,在体外对患者的造血干细胞基因组序列进行修改,于患者的造血干细胞中阻断BCL11A的表达,从而让胎儿血红蛋白的表达不再受抑制,使患者能够摆脱异常的血红蛋白β链的影响,实现基因编辑。
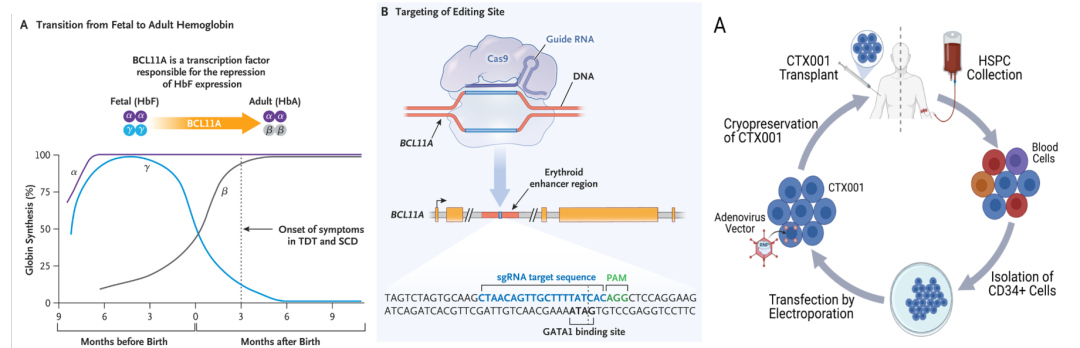
CRISPR-Cas9基因编辑技术【3】
两种基因治疗均表现出非常出色的疗效:
Casgevy临床试验治愈率达96.7%(共30名受试者,且未出现相关严重不良事件);
Lyfgenia临床试验治愈率达93.5%(共31名受试者,且未出现相关严重不良事件)。
02 风险并存,体内基因编辑突显优势
尽管Casgevy和Lyfgenia带来了令人振奋的治疗效果,其面临的挑战也需要我们审慎对待。首当其冲的问题是昂贵的价格,Casgevy定价220万美元,折合人民币超过了1500万,而Lyfgenia更是高达310万美元。这不仅限制了疗法的推广应用,也引发了公众对医疗资源分配公平性的质疑。
价格甚至并非最大的限制因素,两种疗法还存在着不容忽视的风险和缺陷。
不管是Casgevy还是Lyfgenia,患者接受治疗的过程都非常漫长且充满风险。在完成造血干细胞采集后,患者需要等待细胞完成基因工程改造,回输改造后的造血干细胞所需时间很短,但在回输前,患者需要接受化疗药物清除体内的造血干细胞,以为回输的造血干细胞提供必要的生存空间。清除体内造血干细胞后,患者处于严重的免疫抑制状态,必须在医院中等待数周,直到体内的白细胞恢复正常才能出院。
而在Lyfgenia的临床试验中,有两名患者出现了白血病的病例,推测是由于化疗清除造血干细胞导致的。此外,尽管Casgevy在申办方提供的数据中并没有检测到基因编辑脱靶的问题,但要进一步推广这种治疗方案,特别是走向患者更多的常见病领域,其安全性和疗效必须面对更为严格的审查,因此两个针对镰状细胞病的基因疗法都需要进行长达15年的临床试验并进行受试者的长期跟踪。
治疗过程的复杂性也使得该疗法在普及阶段面临着实际操作和技术标准的制约。局限性的适应症范围更是限制了患者群体的广度,令体外基因治疗难以覆盖更多疾病类型。
地中海贫血病患者必须定期输血维生【4】
有投资人表示:“此次获批的CRISPR疗法仍然是体外编辑,更准确的说,这种个性化治疗应被认为是基因编辑作为工具的某种应用,而再下一代的体内基因编辑才更接近于通用性的‘药物’。”
体内基因编辑覆盖更多适应症、靶细胞和靶器官;周期更优,产品为纳米颗粒或者病毒载体等通用型药物形式,无须个性化的细胞制备流程;最重要的是治疗流程更加可控,它简化了治疗流程,减少了外部操作对患者的影响,通过精准的编辑手段直接修复患者体内的异常基因,从而避免了移植过程中可能产生的并发症,成本也要小得多。
03 尧唐生物积极开发多种体内基因编辑药物
“两款疗法进入商业化阶段,国内外多款疗法也都进入临床试验阶段,这是制药史上的一次革命。” 尧唐生物创始人吴宇轩表示:“目前,中国企业把握这次机会正迎头赶上,开发更优的体内基因编辑递送材料。”他以肝脏疾病举例:“过去,很多遗传性危重肝脏疾病患者只能冒着生命危险做成功率低的肝移植,而在体内基因编辑技术成熟后,他们或许只需要接受静脉给药,就能直接干预致病基因从而治愈,“这两种治疗的体验是天差地别的。”
2023年12月初,尧唐生物首个基于LNP递送的体内基因编辑药物在中国申报临床,并获得受理,几天后,该药物在研究者发起的临床研究(IIT)中完成首例患者给药。在药物研发端不断取得突破的同时,尧唐生物在资本端也受到青睐,已在2023年11月底完成了超亿元人民币的A+轮融资。
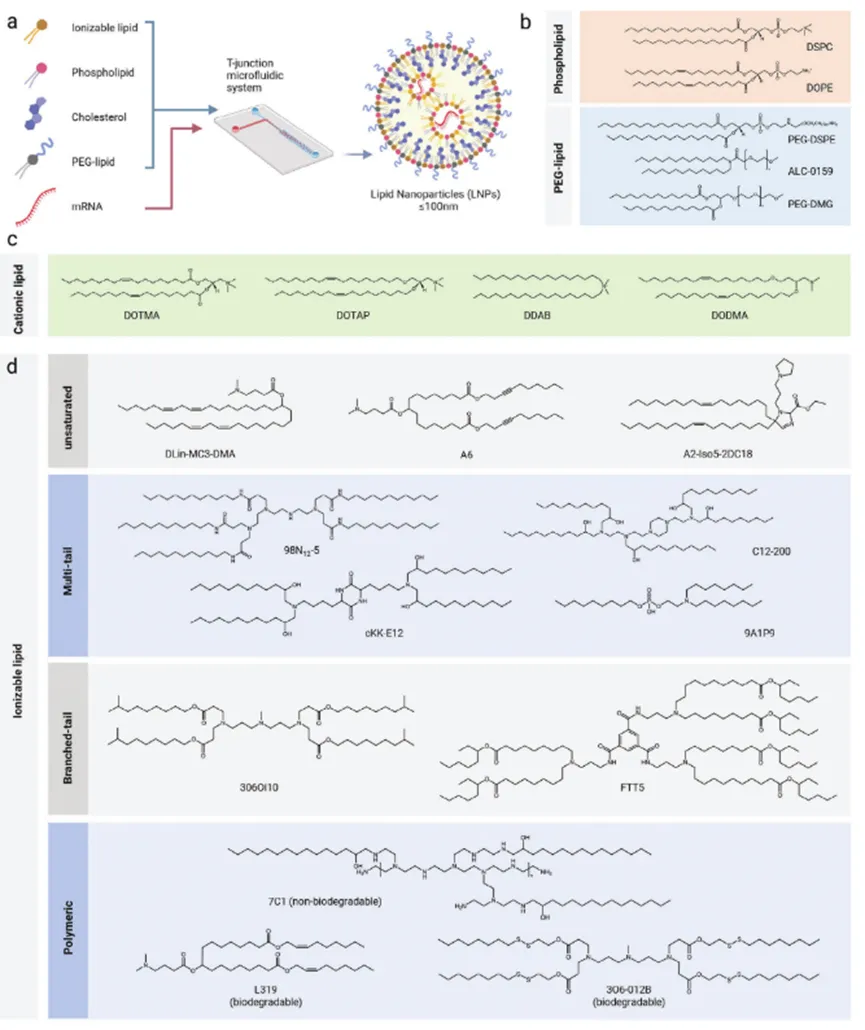
基于脂质的非病毒mRNA载体【5】
尧唐生物致力于开发基于非病毒载体的体内基因编辑药物。在治疗领域方面,当前基因编辑药物面临的一个挑战是如何将该疗法拓展到更多适应症,尤其是使其从罕见病拓展到更广泛的常见病,因为很多适应症不适用于细胞移植的方法。而基于LNP-mRNA递送的体内基因编辑药物是一类通用性的治疗性药物,它可以在药企大规模生产后运输到医院端直接回输到患者体内。而通过与靶向不同组织和器官的载体结合,以及编辑不同的靶点,体内基因编辑药物可以治疗不同的适应症,因此潜力巨大。
传统的基于病毒载体的基因治疗药物生产成本高昂,导致了其售价昂贵。但尧唐生物自主研发的LNP递送系统与之不同,它只包含4种脂质物质,其生产合成成本相对于病毒来说非常低。此外,编码基因编辑器的mRNA的生产也只是个酶促反应,产能很大,成本也相对较低。商业化之后,基于LNP-mRNA递送的体内基因编辑药物的生产成本可以降到传统基因治疗药物成本的5%甚至更低。
吴宇轩博士表示:“随着纳米材料技术的发展,我相信在几年之后,除了现在已有的靶向肝脏的体内基因编辑药物、肌肉注射的mRNA疫苗之外,我们在肺部、血液细胞、免疫细胞、神经细胞等其它组织和器官的递送方面也会取得非常大的进步。等到这些不同的组织和器官的递送问题都解决之后,体内基因编辑或者说基因治疗药物更加会迈入一个崭新的阶段。”
04结语
随着基因编辑疗法的飞速发展,尧唐生物作为领军企业之一,正为未来基因治疗领域的进步贡献着独特的创新和科技实力。尧唐生物在体内编辑治疗领域的研究和产品展现出了引人瞩目的潜力,为我们揭示了未来基因编辑的新篇章。
最后,回顾这一历史性时刻,我们不禁要思考基因编辑疗法对于医学领域的潜在影响。这不仅仅是一项技术的突破,更是对人类健康的一次巨大关怀。基因编辑的正式进入药物阶段,为患者提供了更多的治疗选择,也为医学的发展注入了新的活力。在这个充满希望的时刻,让我们怀揣对未来的期许,共同期待基因编辑疗法为人类带来的更多奇迹。
图片来源:
【1】https://k.sina.com.cn/article_7660012865.html
【2】https://www.fda.gov/media/173473/download
【3】CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia
【4】https://news.sohu.com/a/747379195_121627717
【5】https://mp.weixin.qq.com/s/j0VGybYDXpeJr44quRK8aQ

