腺嘌呤碱基编辑器(ABE)可以高效、产物较纯地将A•T引入G•C 转换;与 CBE 相比,脱靶转录组修饰更少,与当前基于 Cas9 核酸酶的基因编辑方法相比,非目的indels显著减少,且不依赖于DNA双链断裂(DSB)因而风险相对更低【1-4】。
ABE的编辑范围受到Cas蛋白部分的影响,如已有的核酸酶SpCas9受NGG PAM限制,大大限制了腺嘌呤碱基编辑器在全基因组的应用范围;已有的ABE在人造血干/祖细胞中编辑效率极低。因此,ABE所介导的在造血干/祖细胞(HSPCs)中的碱基编辑能够持久修饰血细胞的可行性仍然不确定。
1月13日,尧唐生物创始人吴宇轩与华东师范大学合作在 Nature Communications杂志上在线发表了题为Therapeutic adenine base editing of human hematopoietic stem cells 的研究论文。
在本研究中,吴宇轩团队成功地将腺嘌呤碱基编辑器 ABE8e 及其无 PAM 限制的变体ABE8e-SpRY 以 RNA与蛋白(RNP)复合物的形式应用于 β-地中海贫血患者的造血干/祖细胞(HSPCs),而且对长期造血干/祖细胞(HSPCs)实现有效编辑,从而实现 β-地中海贫血的缓解。

1. ABE8e-SpRY能够在基因组更广泛范围直接修复致病突变
考虑到通过ABE介导的精确编辑消除致病突变可能比HbF的诱导更有效地降低致病性血红蛋白的浓度,因为后者未改变突变的HBB等位基因。研究人员描述了一种定制的、称为 ABE8e-SpRY的变体,这是一个近乎无PAM限制的ABE变体,并将其以应用于在β-地中海贫血病人CD34+ HSPCs中,直接纠正β-珠蛋白基因中的致病性基因突变,如中国常见的两种β-珠蛋白基因突变:HbE(CD 26,G>A,云南省β-地贫最常见突变类型) 和 IVS II-654(C>T,福建省β-地贫最常见突变类型)。并且证实这种碱基编辑策略在体外和体内的HSPCs中都是有效的。研究人员同时检查了HSPCs中碱基编辑的潜在不良后果:碱基编辑器可能导致旁观者编辑,即编辑附近的核苷酸。在本研究中,ABE8e在修复HbE时产生一小部分错义旁观者等位基因,值得注意的是,ABE8e-SpRY在修复HbE时的优势在于比ABE8e具有显著降低的旁观者 (bystander) 编辑效率;在IVS II-654致病突变的优势在于ABE8e由于突变为点附近无合适NGG PAM从而无法进行直接修复,而ABE8e-SpRY则能直接发挥突变修复作用来消除致病的根本原因。本研究为使用 ABE 在基因组更广泛范围内修复突变、治疗遗传疾病提供了支持。
2. ABE可实现对长期 HSCs(LT-HSCs)的高效编辑,诱导高水平HbF表达
研究人员证实了编辑后的正常人来源的干细胞在序贯的初次移植和二次移植至小鼠骨髓4个月后仍然保持着极高的编辑效率,且初次移植和二次移植分离出来的骨髓细胞都具有与植入细胞相当的编辑效率,表明 ABE8e 可以有效地编辑长期造血干细胞。同时也证实该基因编辑能在体内激活红细胞中胎儿血红蛋白的表达。最后,研究人员证明了β-地中海贫血病人来源的CD34+细胞也能被高效编辑且在编辑后移植至小鼠体内重建人源血液系统,同时红细胞中HbF的提升水平可以在很大程度上帮助细胞抵抗珠蛋白不平衡。
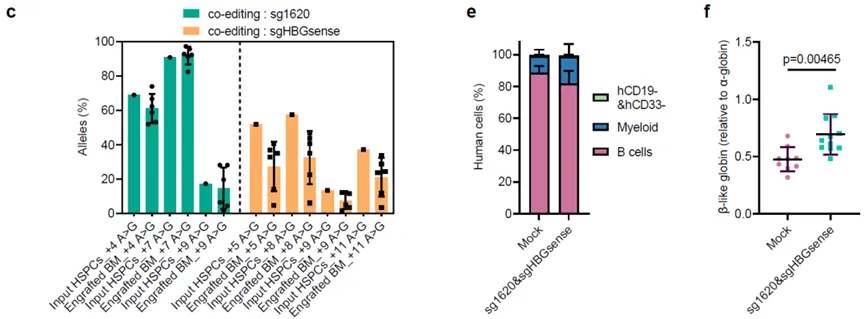
总的来说,本研究提供了证据,证明RNP形式递送的高效、特异性和疾病改善的腺嘌呤碱基编辑在人类 HSC中是可行的,并支持ABE8e和ABE8e-SpRY在自体HSC中的编辑的临床开发,作为β-血红蛋白病的潜在治愈性疗法。目前还没有利用此方法治疗地中海贫血的临床实验报道,有望成为首批进入临床阶段的基因编辑治疗产品。
尧唐生物创始人吴宇轩教授为论文通讯作者。华东师范大学廖娇阳博士、陈双红博士和博士生萧圣霖、蒋艳红是本文的共同第一作者。
原文链接:https://doi.org/10.1038/s41467-022-35508-7
参考文献:
1. Gaudelli, N. M. et al. Programmable base editing of A*T to G*C in genomic DNA without DNA cleavage.Nature 551, 464-471, doi:10.1038/nature24644 (2017).
2. Komor, A. C., Kim, Y. B., Packer, M. S., Zuris, J. A. & Liu, D. R. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature 533, 420-424, doi:10.1038/nature17946 (2016).
3. Zuo, E. et al. Cytosine base editor generates substantial off-target single-nucleotide variants in mouse embryos. Science 364, 289-292, doi:10.1126/science.aav9973 (2019).
4. Doman, J. L., Raguram, A., Newby, G. A. & Liu, D. R. Evaluation and minimization of Cas9-independent off-target DNA editing by cytosine base editors. Nat Biotechnol 38, 620-628, doi:10.1038/s41587-020-0414-6 (2020).

