2025年4月26日,中国上海,尧唐(上海)生物科技有限公司(简称:尧唐生物)宣布,由尧唐生物作为合作单位、上海交通大学医学院附属仁济医院发起的“YOLT-101治疗家族性高胆固醇血症(FH)的临床探索研究(NCT06458010)”取得了重大进展,并将主要临床数据发表于medRxiv。研究数据表明,尧唐生物自主研发的创新体内碱基编辑药物YOLT-101仅需单次给药,即可安全、高效地降低FH患者血浆低密度脂蛋白胆固醇(LDL-C)水平。在降血脂药物研发领域的激烈竞争中,YOLT-101作为最新一代的基因编辑类药物,让降血脂药从每日口服的小分子药物、数月注射一次的小核酸药物,直接进入到了“只需一次给药,终生降血脂”时代。
YOLT-101是尧唐生物自主研发的新一代体内碱基编辑药物,其创新性的采用了尧唐自主专利的腺嘌呤碱基编辑器YolBE(具体指hpABE5,由nCas与来自于Hafnia paralvei的全新脱氨酶融合产生),以及新型脂质纳米颗粒(LNP)作为递送载体。与传统CRISPR/Cas9技术依赖DNA双链断裂不同,YolBE可在不导致DNA双链断裂的前提下实现单碱基精准编辑,大幅降低染色体异常和脱靶风险,大量临床前研究显示其具有极佳的基因组编辑安全性。将基因编辑器应用于FH这样的常见病治疗时,监管机构、患者和医生对编辑器的安全性要求会更高。因此,相对于传统的Cas9编辑器,YolBE机制上更具安全性优势,也更适合心血管疾病等患者基数大的常见病的治疗。
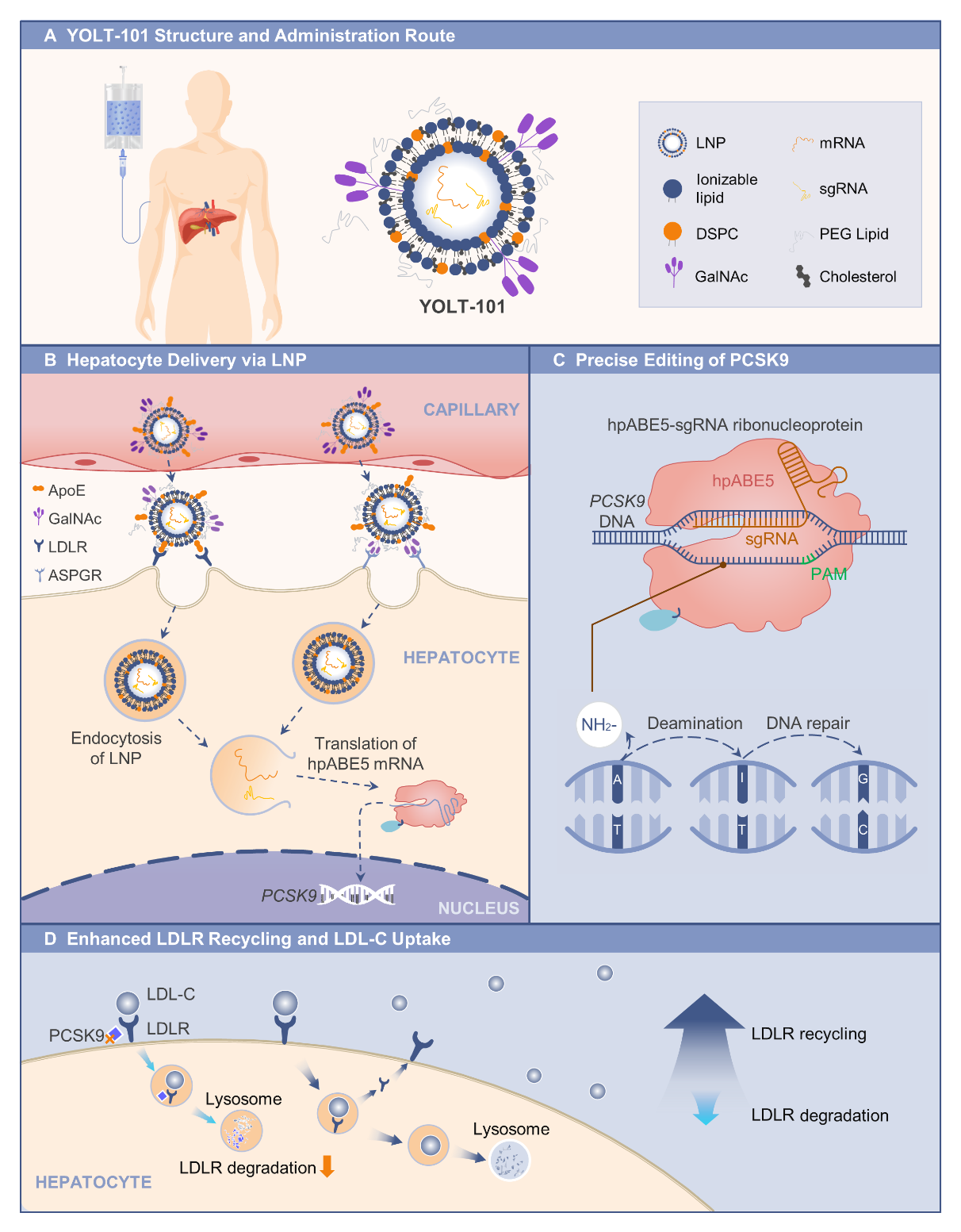
YOLT-101降低PCSK9和LDL-C的作用机制图。
YOLT-101通过静脉输注给药,并靶向作用于肝脏细胞,精准编辑PCSK9基因目标区域的单碱基,沉默PCSK9基因的表达。PCSK9蛋白表达减少,导致PCSK9介导的LDLR降解减少。肝脏细胞表面LDLR对LDL-C的摄取增加,从而降低血液LDL-C水平。
试验设计
这是一项针对杂合子家族性高胆固醇血症(HeFH)患者中进行的开放标签临床试验。该试验的主要目的是评估YOLT-101的安全性和耐受性,并对初步疗效和药效学进行深入分析。截至2025年3月15日,共纳入了6例受试者,其中0.2 mg/kg组1例,0.4 mg/kg组2例,0.6 mg/kg组3例。受试者安全性随访最长已达36周,且均完成24周的安全性访视。
安全性与耐受性结果
YOLT-101的安全性和耐受性良好。截至2025年3月15日,所有剂量组均未发生严重不良事件(SAE),未发生剂量限制性毒性(DLT)事件、CTCAE v5.0标准3级或以上的不良事件。所有入组受试者均按计划随访中。
最常见的与研究药物有关的不良事件是给药后一过性的输液相关反应(5/6, 83.3%),以发热为主要表现,24小时内消退;其次为给药后4至7天出现的一过性轻度肝酶升高(3/6, 50.0%),7天后迅速恢复,且这些受试者给药后没有相关症状,肝功能的重要评估指标血胆红素也一直保持正常。其他实验室指标未发现有临床意义的改变。
疗效和药效学结果
给药后,LDL-C水平下降呈现剂量依赖性。参与疗效分析的受试者均已完成至少16周的随访。受试者基线LDL-C水平为4.9±0.6 mmol/L。在0.4 mg/kg组和0.6 mg/kg组,给药后第1周即可观察到持续LDL-C下降,并从4周起达到稳态。0.6 mg/kg组的受试者在给药后4周起LDL-C平均降幅约50%。其中降幅最大受试者下降超过74%, LDL-C水平稳定在约1 mmol/L,单次给药后已维持降低超过半年。药效学指标血浆PCSK9蛋白的变化和以上结果保持一致;0.6mg/kg组从给药后4周起平均PCSK9较基线下降幅度始终在70%以上,个体最大降幅达87%。
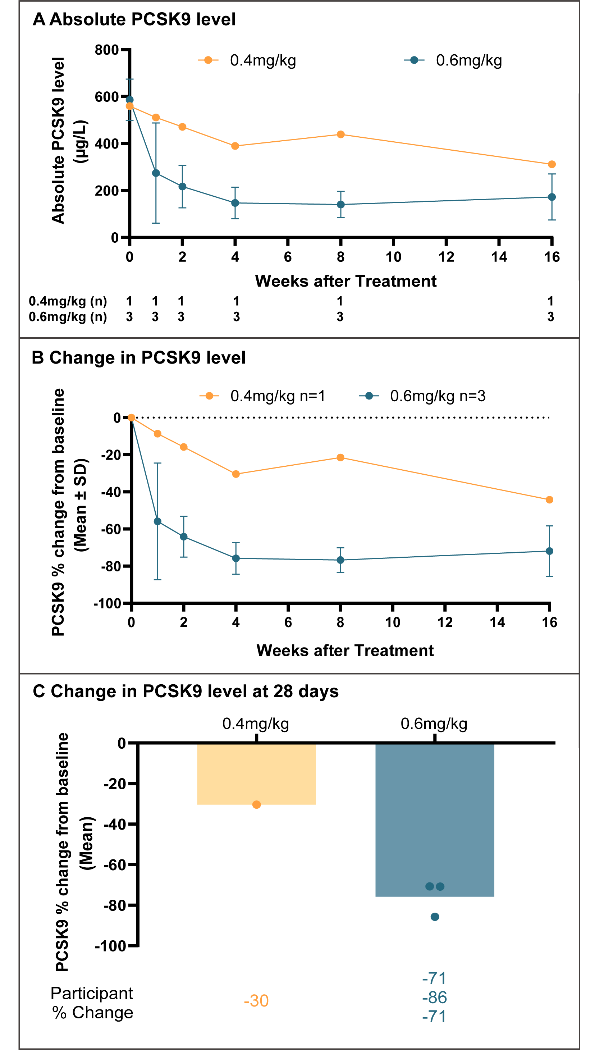
YOLT-101给药前后PCSK9蛋白水平及较基线百分比改变
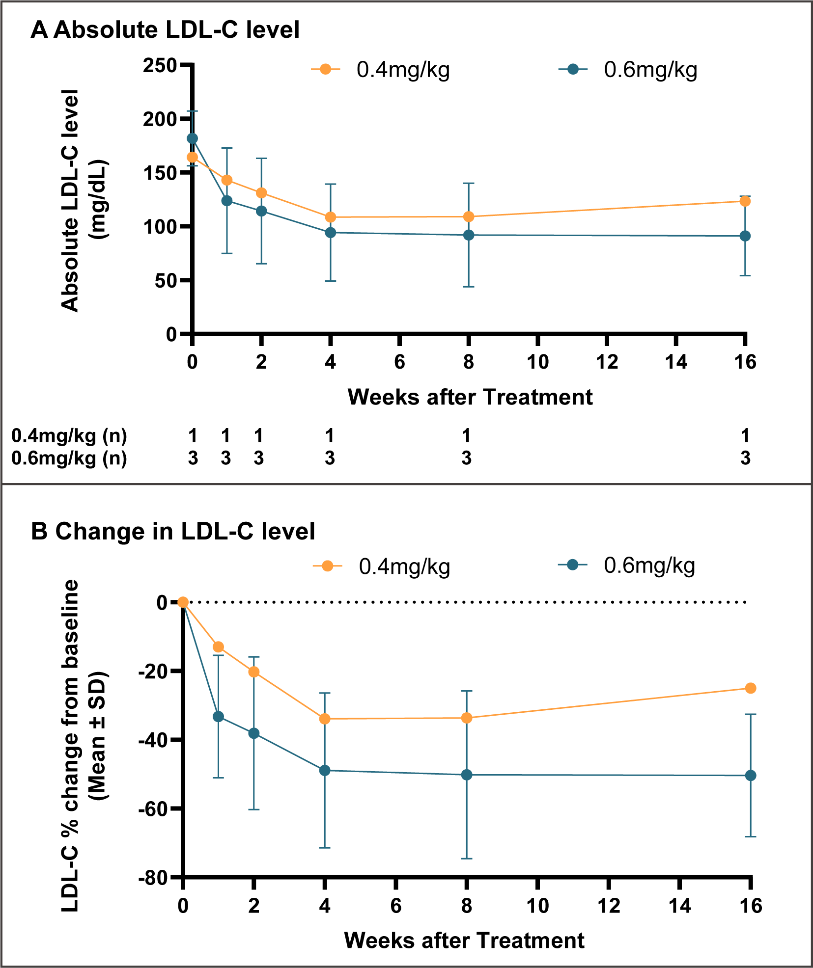
YOLT-101给药前后LDL-C水平及较基线百分比改变
值得一提的是,本研究所入组的患者皆为HeFH。PCSK9靶向药物在HeFH患者中的降脂效果相较于普通高血脂患者更差。这也提示,YOLT-101未来在普通高血脂患者身上,有望展现出更大幅度的降血脂效果。
上述临床结果提示,YOLT-101在HeFH患者中安全性和耐受性佳,不良反应轻微且短暂。药效学指标PCSK9和疗效指标LDL-C均在0.4 mg/kg和0.6 mg/kg组观察到持久、稳定的下降,并显示剂量依赖性,提示YOLT-101具有“一次给药,终生降血脂”的潜力。
论文链接:
https://www.medrxiv.org/content/10.1101/2025.04.17.25325983v1
https://doi.org/10.1101/2025.04.17.25325983
仁济医院夏强院士、杨太华博士,以及尧唐生物创始人吴宇轩博士和王子君博士为本文的共同通讯作者。仁济医院万平博士、汤思源博士、林冬妮博士、龙玫博士以及尧唐生物陆钰明博士为本文的共同第一作者。
“我们致力于通过新一代碱基编辑技术,彻底革新心血管疾病的传统治疗模式,为患者提供一种全新的单次给药治疗方案。”尧唐生物创始人兼首席执行官吴宇轩博士表示,“杂合子型家族性高胆固醇血症(HeFH)患者很多无临床症状,但由于低密度脂蛋白胆固醇(LDL-C)代谢先天异常,从出生起血液LDL-C水平显著升高,是早发冠心病的高危人群。现有的LDL-C下降治疗均强调长期、规律用药,且停药后LDL-C水平会反弹,面临依从性管理、药物不耐受等诸多治疗痛点。YOLT-101预期精准编辑肝脏中调控LDL-C的关键基因,现有疗效数据显示出单次给药即可持续降低LDL-C水平,有望实现‘一次注射,终生有效’的治疗效果,终生降低HeFH患者心血管并发症的发生风险。我们期待通过更大规模的临床研究,进一步验证其安全性与疗效,并推动这一疗法早日造福全球患者。”
关于家族性高胆固醇血症(FH)
家族性高胆固醇血症(FH)是由LDL-C代谢的关键基因发生致病性突变所引起一种常染色体遗传病,主要特征为血液中高水平的LDL-C,血管内沉积可导致早发、进行性的动脉粥样硬化性心血管疾病(ASCVD)。FH是最常见的遗传性疾病之一,全球FH患病率约为1/250-1/200,患者总数超3400万;中国FH患者约300万-500万(《中国成人血脂异常防治指南》数据),但诊断率不足5%,治疗缺口显著。
目前FH的治疗手段包括生活方式干预、降脂药物治疗、脂蛋白血浆置换及肝移植手术治疗等。其中,最主要的治疗方式为服用降脂药物。临床上对FH患者通常采取他汀类药物、依折麦布与PCSK9抑制剂三联疗法,但基于现有的治疗手段,患者在治疗过程中往往面临疗效欠佳、药物副作用无法耐受、需终身用药而依从性差等许多难题。
关于YOLT-101
YOLT-101注射液药物能在DNA单碱基水平精准编辑并沉默PCSK9基因,下调血液中的PCSK9蛋白水平,抑制PCSK9介导的低密度脂蛋白受体(LDLR)降解,从而增强LDLR对低密度脂蛋白的摄取,有效清除血液中的低密度脂蛋白胆固醇(LDL-C),最终延缓和治愈家族性高胆固醇血症。基于相同的基因编辑机制,该药物未来还可拓展至普通高脂血症的治疗领域——全球约13亿成人患有非遗传性高胆固醇血症(WHO 2023年数据),其中约30%患者对现有降脂药物反应不足。通过靶向沉默PCSK9基因,YOLT-101有望为这类患者提供长效、精准的LDL-C控制方案。2025年4月17日,国家药品监督管理局药品审评中心受理YOLT-101注射液按1类新药申报的临床试验申请。
关于尧唐生物
尧唐生物是一家以创新为驱动,专注于开发基于mRNA-LNP递送的体内基因编辑药物的高科技生物医药公司。尧唐生物成立于2021年,依托多个技术创新平台,成功发掘和进化了新一代基因编辑器YolCas™和碱基编辑器YolBE®,获得了具有自主知识产权的新型脂质纳米颗粒YOL-LNPs®,实现了更高效率的体内递送。公司已经建立了上海总部研发中心和GMP生产基地,拥有先进的mRNA-LNP生产工艺及完善的体内基因编辑药物生产和质量控制平台。尧唐生物自主研发的首个针对ATTR的体内基因编辑药物的临床试验已于2024年3月获得国家药品监督管理局药品审评中心(CDE)批准,2024年6月成功完成首例患者入组,标志着国内首个LNP介导的体内基因编辑药物进入临床阶段,并于2025年1月进入剂量拓展阶段。同时,基因编辑治疗家族性高胆固醇血症(FH)和原发性高草酸尿症(PH1)的项目已成功开展了研究者发起的临床研究,初步取得了优异的临床效果。

